Stellungnahme Kommission für Infektionskrankheiten und Impffragen der DAKJ
Aus Gründen der besseren Lesbarkeit wird auf die gleichzeitige Verwendung männlicher und weiblicher Sprachformen verzichtet. Sämtliche Personenbezeichnungen gelten geschlechterunabhängig. Hier geht es zum PDF.
Zusammenfassung
Für diese Stellungnahme werden verfügbare Daten zu den Impfzeitpunkten bei einigen Standardimpfungen von Kindern und Jugendlichen analysiert und bewertet. Bei den meisten dieser Impfungen sind die Impfquoten bei Einschulung auf einem befriedigenden Niveau. Alle Impfungen erfolgen jedoch bei einer großen Zahl von Kindern verzögert und Impfserien werden somit oftmals nicht im empfohlenen Zeitrahmen abgeschlossen. Einige Kinder erhalten manche Impfungen gar nicht. Die Impfquoten weisen große regionale Unterschiede auf.
Das hat verschiedene Konsequenzen. Kinder sind einer erhöhten Infektionsgefahr ausgesetzt und Herdenschutz stellt sich spät oder nicht ausreichend ein, wie am Beispiel von Pertussis, Masern und Rotaviren gezeigt wird.
Gründe für eine verzögerte Impfteilnahme sind vielfältig. Sie liegen zum einen in den Lebensverhältnissen der Familien sowie persönlichen Vorbehalten und Sorgen der Eltern. Entscheidend ist in besonderer Weise die Einstellung des impfenden Arztes. Die Kommission macht Vorschläge zum zeitgerechten Impfen von Kindern und Jugendlichen. Die üblichen Impfroutinen in den Praxen müssen überdacht werden und dringend besser an die Empfehlungen angepasst werden. Die Barrieren für die Teilnahme an einer Impfung sollten niedrig sein, der Zugang so einfach wie möglich.
1. Einleitung: Bedeutung des Problems
Es ist eine wichtige ärztliche Aufgabe, Kindern und Jugendlichen alle für sie empfohlenen Impfungen zeitgerecht anzubieten. Das betrifft sowohl Standard- als auch Indikationsimpfungen. Zur Vermeidung von Immunitätslücken sollen bei allen Säuglingen die Standardimpfungen gemäß STIKO frühzeitig mit 6 Wochen (Rotavirus), zwei Monaten (DTaP-IPV-HBV-Hib und Pneumokokken) sowie 11 Monaten (MMR, Var) (Tabelle 1) begonnen, ohne Verzögerungen durchgeführt und inkl. der 2. MMR/V-Impfung zeitgerecht im Alter von 15 Monaten abgeschlossen werden. Auch Impfungen bei älteren Kindern und Jugendlichen sowie Indikationsimpfungen für bestimmte Personen sollen zeitgerecht angesprochen und verabreicht werden [1].
Junge Säuglinge sind aufgrund des unzureichenden oder nachlassenden Nestschutzes durch Infektionserreger gefährdet, die entweder häufig und hoch kontagiös (wie Rotaviren, Bordetella pertussis oder Masernviren) oder vom Immunsystem nicht sicher kontrollierbar sind (wie die bekapselten Bakterien Haemophilus influenzae Typ b (Hib), Meningo- und Pneumokokken). Ziel einer zeitgerechten Impfung ist, Säuglingen und Kleinkindern zum frühestmöglichen Zeitpunkt einen Schutz vor diesen Erregern zu verschaffen.
|
Alter |
Impfung |
Grund für eine frühzeitige Impfung |
|
6 (-8) Wochen |
Rotaviren |
Schwere Verläufe und viele Hospitalisierungen bei Säuglingen [2] |
|
(6 Wochen -) 2 Monate |
Pertussis (DTaP-IPV-HBV-Hib)-Impfung |
Schwere Verläufe und viele Hospitalisierungen bei Säuglingen [2], [3] |
|
|
Haemophilus influenzae Typ b, Pneumokokken |
Schwere Verläufe bei Säuglingen und Kleinkindern möglich [2] |
|
(6-) 11 Monate |
Masern (MMR/V oder MMRV) |
Hohe Krankheitszahlen und Komplikationsraten bei Ausbrüchen im Säuglings- und Kleinkindalter [2],[4], [5] |
|
(9-) 11 Monate |
Varizellen
|
hohe Krankheitszahlen und Komplikationen bei jungen Kindern |
|
11 Monate |
3. DTaP-IPV-HBV-Hib- und Pneumokokken- Impfung |
wichtig um Immunitätslücken wegen nachlassendem Schutz zu vermeiden |
|
9 Jahre |
HPV (Humane Papillomaviren) |
Hohe Effektivität der Impfung bei jungen Kindern |
Tab. 1: Allgemein empfohlene, frühestmögliche Impfzeitpunkte ausgewählter Standardimpfungen nach STIKO [1]
Im Folgenden werden aktuelle Daten zu den tatsächlichen Impfzeitpunkten für einige Standardimpfungen und bekannte Erkrankungszahlen im frühen Kindesalter vorgestellt. Neben Querschnittsuntersuchungen (z.B. Kiggs, Schuleingang), die eine Beschreibung der Vollständigkeit der Impfteilnahme erlauben, können mit Hilfe der Abrechnungsdaten für die Krankenkassen tatsächliche Impfzeitpunkte für verschiedene Alterskohorten sowie regional differenziert beurteilt werden.
Messmethoden und Datengrundlage [6]
Zur flächendeckenden Bestimmung der Impfquoten bei Kindern und Jugendlichen stehen zwei unterschiedliche Methoden zur Verfügung: Impfraten können bei den Schuleingangsuntersuchungen oder auf Grundlage der kassenärztlichen Abrechnungsdaten (KV -Daten) erfasst werden.
- Schuleingangsuntersuchungen: seit 2001 werden nach IfSG §34 (11) Daten zu den Impfungen bei Schuleingang bundeseinheitlich erhoben und in den Bundesländern und am RKI zusammengefasst. Datengrundlage sind die vorgelegten Impfpässe. So kann eine komplette Kohorte von Kindern beurteilt werden. Es besteht die Möglichkeit der Intervention, Impflücken können geschlossen werden. Damit wird die Impfteilnahme in Bezug auf einzelne Impfstoffe bestimmt.
- Limitationen: Impfpässe liegen meist nur bei 90% der Kinder vor. Vermutlich werden die Impfquoten überschätzt, bei Kindern mit einem fehlenden Impfdokument sind Impfserien oft unvollständig. Weiterer Nachteile sind, dass Impfungen erst einige Jahre nach dem eigentlich empfohlenen Impfzeitpunkt erfasst werden und Impfungen, die nach Einschulung erfolgen, nicht beurteilt werden können.
- KV-Daten: Daten zu den abgerechneten Impfleistungen aller Kassenärztlichen Vereinigungen werden seit März 2020 nach IfSG § 13 (5) ans RKI gemeldet und zentral ausgewertet. Das setzt die seit 2004 bestehende „KV-Impfsurveillance“ fort. Datengrundlage sind die Abrechnungsdaten der KV zu Impfleistungen, quartalsweise übermittelt. Hier werden nur gesetzlich Versicherte erfasst, das sind (mit gewissen regionalen Unterschieden) etwa 85% der Bevölkerung. Es werden keine Impfungen von anderen Anbietern registriert (ÖGD, Betriebsärzte, Kliniken o.a.). Unter Berücksichtigung dieser Begrenzungen können Impfquoten in jeder Altersgruppe, bundesweit und regional bestimmt werden; es lassen sich die Vollständigkeit der erhaltenen Impfungen, Impfzeitpunkte und -abstände ableiten.
2. Impfzeitpunkte und Erkrankungszahlen für einzelne Infektionserreger
6-fach Impfung (Diphtherie-Tetanus-Pertussis-Polio IPV- Hib – Hepatitis B), erste Lebensjahre
2.1.1 Allgemeines
Grundimmunisierung: Seit 2020 soll die erste Impfung im Alter von zwei Monaten, die zweite mit vier Monaten, und die dritte mit 11 Monaten verabreicht werden (2+1-Schema). Fehlende Impfungen können jederzeit nachgeholt werden. Laut den bis 2020 gültigen Empfehlungen sollte die erste Impfung mit zwei, die zweite mit drei und die dritte mit vier Monaten erfolgen, die vierte Impfung zwischen 11 und 14 Monaten (3+1-Schema).
|
Impf-Alter in Monaten |
1.Dosis |
2.Dosis |
3. Dosis (3+1) |
4. Dosis (3+1) |
|
2 |
33,3%* |
|
|
|
|
3 |
68,6% |
23,3%* |
|
|
|
4 |
86,0% |
56,6% |
15,1%* |
|
|
6 |
91,0% |
83,5% |
60,2% |
|
|
12 |
94,4% |
92,3% |
84,8% |
6,9% * |
|
14 |
|
|
|
31,4%* |
|
18 |
|
|
|
61,1% |
|
24 |
|
|
|
74,6% |
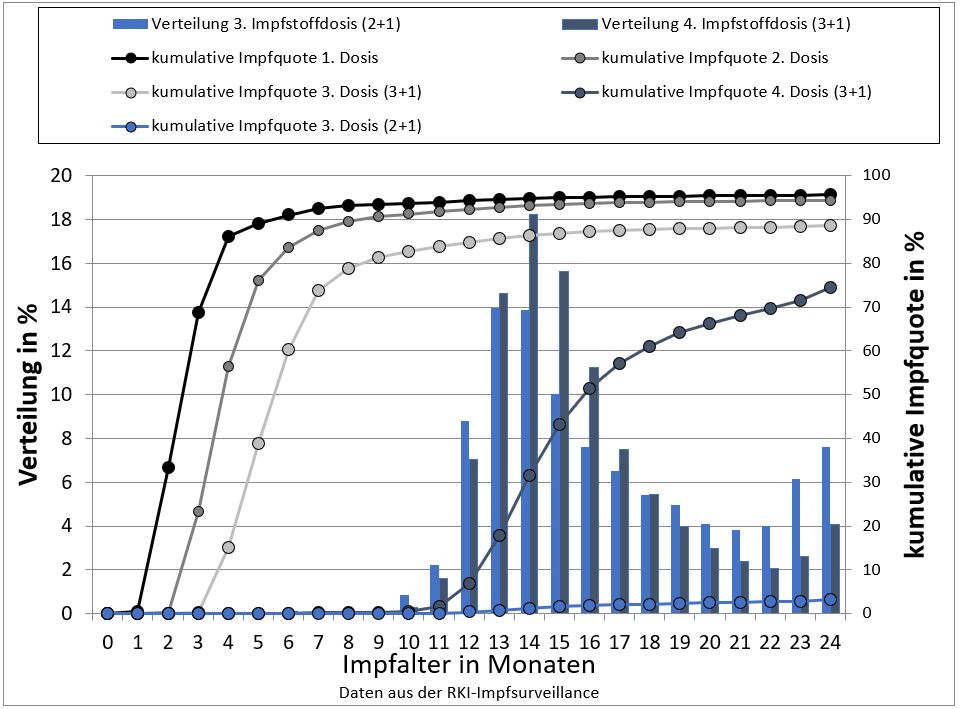
Tab. 2: Kumulative Impfquoten der Hib-Impfung für die 1., 2., 3. und 4. Impfung nach dem 3+1 Schema. Geburtsjahrgang 2016, Daten aus der RKI-Impfsurveillance, freundlicherweise zur Verfügung gestellt von Thorsten Rieck, RKI, 2020.
*empfohlene Impfzeitpunkte für die 1. bis 4. Impfung
Die Daten aus der KV-Impfsurveillance zeigen, hier beispielhaft für die Hib-Impfung des Jahrgangs 2016 (Tab 2 und Abb. 1), dass mit zwei Monaten nur 33,3% der Kinder die erste Impfung erhalten. Mit vier Monaten haben 15,1% und mit sechs Monaten 60,2% der Kinder alle drei empfohlenen Impfungen erhalten. Die Grundimmunisierung fängt im ersten Lebensjahr bei zwei von drei Kindern sehr viel später an als von der STIKO vorgesehen und wird bei 70% nicht innerhalb des empfohlenen Zeitrahmens abgeschlossen.
Mit 15 Monaten haben 96% der Kinder eine, 89,7% (Spannweite auf KV-Ebene: 86,6-92,6%) drei Impfungen mit DPT-basierten Kombinationsimpfstoffen erhalten; hier sieht man keine Änderung seit dem Jahrgang 2008. 6,5% der Kinder, die eine erste DPT erhalten haben, haben keine dritte Impfung mit 15 Monaten (sog. Abbruchquote) [7].
78% der Kinder haben mit 24 Monaten eine abgeschlossene Impfserie gegen DTaP-Polio und Hib (Abb. 1). Die Impfquoten steigen bis zur Einschulung auf weit über 90% der Kinder, ausgenommen in Baden-Württemberg und Bremen; hier waren 2018 die Impfquoten unter 90% [7].
Abb. 1: Kumulative Impfquote für die Hib-Impfung in den ersten 24 Lebensmonaten für die 1., 2., 3. und abschließende 4. Impfstoffdosis des 3+1-Impfschemas und der 3. abschließenden Impfstoffdosis des 2+1-Impfschemas sowie Verteilung der Impfzeitpunkte der abschließenden Impfstoffdosen, Geburtsjahrgang 2016 (Daten der RKI -Impfsurveillance, zur Verfügung gestellt von Thorsten Rieck, RKI, 2020)
Fazit: Die Impfquoten gegen DTaP-Polio und Hib sind bei jungen Kindern inakzeptabel niedrig. Die Impfungen ziehen sich über einen langen Zeitraum hin und erfolgen zu spät. Sie werden zwar bis zur Einschulung teilweise nachgeholt, aber auch zu diesem Zeitpunkt bestehen noch relevante Impflücken. Junge Kinder sind unnötig lange einer Infektionsgefahr ausgesetzt, in einem Lebensabschnitt, in dem sie ein besonders hohes Risiko für schwere, impfpräventable Krankheiten wie z.B. Pertussis haben.
Die Zahl der Kinder, die mit 15 Monaten drei Impfungen erhalten haben (“DTP3”) ist ein international genutztes, wichtiges Kriterium, um die Qualität eines Routine-Impfsystems zu beurteilen. Die Zahl der Kinder, die mit 15 Monaten eine DTP, jedoch noch keine drei Impfungen erhalten haben, ist mit 6,5% in Deutschland sehr hoch. Ziel der WHO ist eine Abbruchrate von weniger als 5% in der WHO-Euro-Region [8].
2.1.2. Pertussis
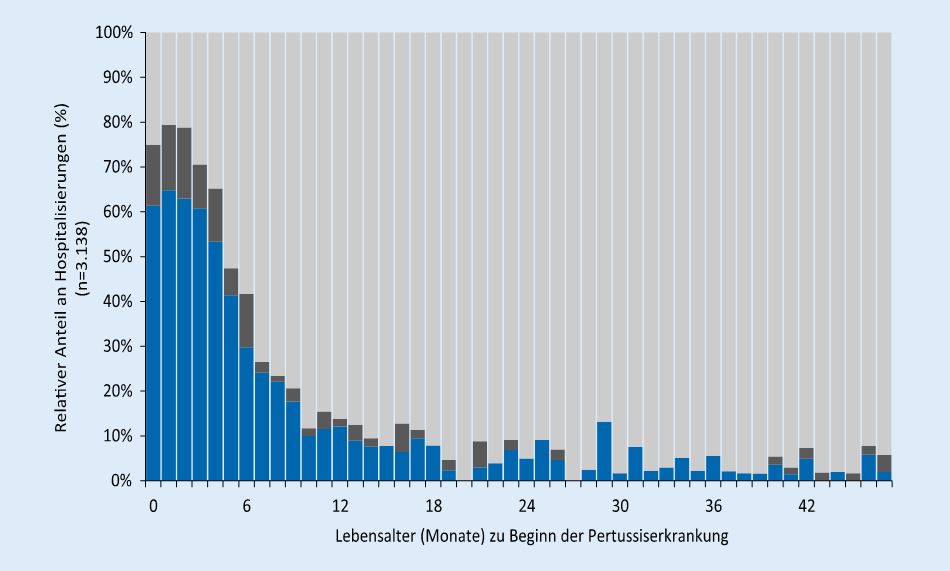
Keuchhusten ist eine häufige Infektionskrankheit, verursacht durch Bordetella pertussis. Wegen eines zeitlich begrenzten Immunschutzes sowohl nach Impfung als auch nach durchgemachter Erkrankung tritt Keuchhusten in allen Altersgruppen auf. Die Weiterverbreitung erfolgt überwiegend durch Jugendliche und Erwachsene mit unzureichendem eigenen Schutz [9]. Schwere, auch tödliche Verläufe und Komplikationen treten meist bei Säuglingen auf: darunter sind Kinder mit Apnoen und Bradykardien, einer leukämoiden Lymphozytose [10] oder dystelektatischen Pneumonien. Mehr als die Hälfte der in den ersten fünf Lebensmonaten erkrankten Kinder werden stationär behandelt [2], siehe Abb. 2.
Abb. 2: Anteil der hospitalisierten Kinder mit Pertussis in % an allen erkrankten Kindern. Blau: Hospitalisierung wegen Pertussis, dunkel: anderer Aufnahmegrund. N=3138 Kinder, Meldezeitraum 2014-2018. IfSG-Meldedaten vom Robert Koch-Institut, Bild aus [3]
Seit 2013 besteht eine bundesweite Meldepflicht. Die jährliche Inzidenz über alle Altersgruppen beträgt 11-40 Erkrankungen/100.000 Einwohner.
Die mittlere Inzidenz bei Säuglingen zwischen 2014 und 2018 lag bei 50 Erkrankungen/100.000 Kinder unter einem Jahr. Am häufigsten erkrankten Säuglinge in den ersten sechs Monaten (Abb.3). Man muss jedoch von einer hohen Untererfassung ausgehen [11]. Auch bei Jugendlichen ist die Inzidenz mit ca. 22 Erkrankungen/100.000 Einwohner hoch [2].
Zwischen 2014 und 2019 traten bei Säuglingen im Mittel 444 Erkrankungen pro Jahr auf. 72,5% dieser Kinder waren ungeimpft, von den geimpften hatten 44% bis dato nur eine Dosis erhalten. Bei Kindern unter drei Monaten traten im Mittel 109 Erkrankungen/Jahr auf. Bei Säuglingen zwischen drei und elf Monaten gab es im Mittel 239 Erkrankungen/Jahr; von diesen Kindern hatten 58% keine und 23% nur eine Impfung [12]. Diese Zahlen belegen, wie entscheidend ein frühzeitiger Abschluss der Impfserie ist.
Dies wird auch durch eine ESPED-Erhebung unterstrichen [13]: Es werden viele stationäre Behandlungen und schwere Verläufe vor allem bei Säuglingen beschrieben. Dies waren überwiegend nicht altersgerecht geimpfte Kinder. Es wurde auch die Effektivität der Impfstoffe geschätzt: die Effektivität von abgeschlossenen Impfungen betrug 96,6%, eine partielle Impfung mit zwei Dosen zeigte schon einen Schutzeffekt mit einer Effektivität von 78,3%. Eine aktuelle Studie aus der Schweiz kommt zu ähnlichen Ergebnissen: die Effektivität des Pertussisimpfstoffes wird auf 42,1% nach der ersten, 83,9% nach der zweiten, 98,2% nach der dritten und 100% nach der vierten Impfdosis geschätzt (3+1 Schema) [14].
Abb.3 zeigt die hohen Erkrankungszahlen mit Pertussis in den ersten sechs Monaten während der letzten Jahre. Gleichzeitig sind die die tatsächlichen Impfzeitpunkte aufgeführt. diese erfolgen häufig zu spät, um einem nennenswerten Teil der Kinder einen Immunschutz im ersten halben Jahr zu ermöglichen (hier mit drei Impfdosen nach dem 3+1-Schema). So haben 80% der Kinder erst mit vier Monaten eine und mit sechs Monaten zwei Impfdosen erhalten, das ist deutlich nach dem Krankheitsgipfel der ersten sechs Monate.
Insbesondere um den Schutz von jungen Säuglingen zu verbessern hat die STIKO in den letzten Jahren die Pertussis-Impfempfehlungen immer wieder angepasst [3]. Dazu gehört die Impfempfehlung für Erwachsene [15], vor allem auch bei beruflicher Indikation [16], seit 2004 die Cocoon-Strategie (Impfung der Haushaltsangehörigen eines Neugeborenen vor oder nach der Geburt) und seit 2020 die Impfung Schwangerer im letzten Trimenon [17]. Damit sollen insbesondere Erkrankungsfälle in den ersten Lebensmonaten reduziert werden, die auftreten können, bevor ein belastbarer Immunschutz des Kindes aufgebaut ist.
Fazit: Die Pertussis-Impfungen bei Säuglingen erfolgen zu spät, ca. 40% der sechs Monate alten Kinder haben noch keinen oder nur einen partiellen Impfschutz (Tab. 2). Die Impfserien werden oft erst nach dem zweiten Geburtstag abgeschlossen. Zum Schutz der jungen Säuglinge ist in der Kinderarztpraxis die zeitgerechte Durchführung der Impfungen mit 2, 4 und 11 Monaten notwendig, um eine Vielzahl von schweren Pertussis-Erkrankungen im 1. Lebensjahr zu verhindern. Kinder- und Jugendärzte und Frauenärzte sind gefragt, wenn es um die Impfung von Schwangeren und die Umsetzung der Cocoon-Strategie um und nach der Geburt geht.
Daten: aus der KV-Impfsurveillance, RKI
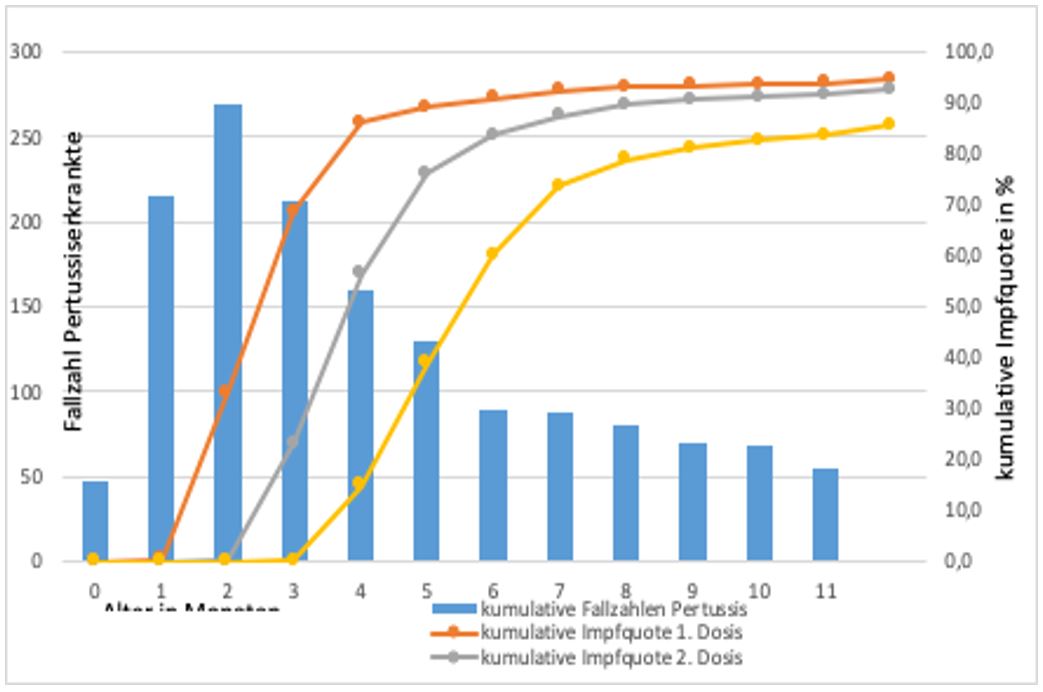
Balken: kumulative Fallzahl der Pertussiserkrankten von 0-12 Monaten nach IfSG im Meldezeitraum 2014-2018, n=1546 Kinder. Meldedaten aus RKI nach [12]
Linien: kumulative Impfquoten gegen Hib im ersten Jahr, Jahrgang 2016, 3+1-Schema. Daten aus der KV Impfsurveillance, T Rieck, siehe Tab.2
Rotavirus
Die Impfung wird seit 2013 von der STIKO empfohlen. Die KV-Daten zeigen eine nur zögerliche Umsetzung dieser Empfehlung Die Impfquoten steigen nur langsam, 78,5% des Jahrgangs 2015 erhielten eine Rotavirusimpfung bis zum Alter von 32 Lebenswochen, 68,5% sind vollständig geimpft (KV-Surveillance, [18]). Es gibt erhebliche regionale Unterschiede. Bei vielen Kindern sind die Impfserien nicht vollständig.
Von den geimpften Kindern erhalten 91,2% die erste Impfung zeitgerecht, d.h. bis zum Alter von 12 Wochen; ca. 9% der Dosen werden später verabreicht. Damit erhöht sich für diese Kinder das Risiko für Invaginationen.
Die Folgen dieser zögerlichen Umsetzung sind deutlich: 2019 wurden bundesweit 36.974 Fälle mit Rotavirus-Gastroenteritis gemeldet [2]. Die Zahl der Erkrankungen hat seit 2008 abgenommen, dieser Trend hatte sich im Jahr 2018 nicht fortgesetzt, die Erkrankungszahlen stiegen 2019 wieder an. 29% der Erkrankungen traten bei Kindern <5 Jahren auf, die höchste Inzidenz bei Kindern im ersten Lebensjahr (364 ./100.000 Einw.). 56% der gemeldeten Fälle von Rotavirus-Gastroenteritis betrafen hospitalisierte Kinder und Jugendliche <15 Jahre. 10.601 Infektionen traten bei Kindern unter 5 Jahren auf, davon waren 1.235 geimpft, 4.715 ungeimpft, bei 4.651 Kindern war der Impfstatus unbekannt. Bei 665 vollständig und zeitgerecht geimpften Kindern ging man von Impfdurchbrüchen aus, von diesen wurden 247 (37%) stationär behandelt.
Fazit: nach wie vor müssen viele Kinder stationär wegen Rotavirus-Infektionen behandelt werden, ein großer Teil dieser Krankenhausaufenthalte hätte durch eine rechtzeitige Rotavirus-Impfung verhindert werden können. Nicht wenige Kinder erhalten die 1. Impfung entgegen der Empfehlung nach der 12. Lebenswoche, wodurch das Risiko für eine Invagination als Impfkomplikation bzw. koinzidierendes Ereignis steigt.
Masern
Auch bei der MMR-Impfung besteht erheblicher Handlungsbedarf. Dass seit mehreren Jahren bei den Schuleingangsuntersuchungen rund 95% der Kinder mit vorgelegtem Impfausweis mindestens einmal gegen Masern (in der Regel MMR) geimpft sind darf nicht darüber hinwegtäuschen, dass auch hier die Impfungen vielfach viel zu spät beginnen und die zweite Impfung zu oft verzögert oder gar nicht erfolgt. Die erheblichen regionalen Unterschiede in den Impfquoten sind dabei gerade bei der MMR-Impfung auf der einen Seite sehr deutlich, auf der anderen Seite (auch bei Berücksichtigung der abweichenden Impfempfehlung in Sachsen) rational nicht begründbar.
Die STIKO empfiehlt zur Zeit die erste Masern-Impfung (ebenso wie Mumps, Röteln und Varizellen) für Kinder im Alter von 11 Monaten, die 2. Impfung mit einem Abstand von ≥4 Wochen, spätestens jedoch mit 15 Monaten [1].
Im Alter von 15 Monaten haben 83,5% der Kinder im Bundesgebiet (Spannweite auf Kreisebene: 59,1-94,6%) eine 1. MMR-Impfung erhalten [7]. Damit wird das Ziel des Nationalen Masernaktionsplans [19] verfehlt, im Alter von 15 Monaten eine Impfquote von 95% für die 1. Masernimpfung zu erreichen.
Im Alter von 24 Monaten haben nur 69,9% der Kinder (Geburtsjahrgang 2016) eine 2. MMR-Impfung erhalten (Spanne auf Kreisebene: 42,0%-87,1%). Die Impfquoten steigen in den folgenden Jahren weiter an. Zum Zeitpunkt der Einschulung haben 91,1% der Kinder eine 2. Impfung erhalten. Bis zum Alter von 72 Monaten haben 95,2% der Kinder eine Impfung und 88,7 % 2 Impfungen; 4,8% haben gar keine Masernimpfung erhalten (Abb. 4).
In allen Alterskohorten gibt es erhebliche regionale Unterschiede bezüglich der Teilnahme und des Zeitpunktes der MMR-Impfungen.
Hochgerechnet auf die Altersgruppe (Jahrgang 2012) haben ca. 83.000 Kinder mit 72 Monaten noch keinen ausreichenden Masernschutz, darunter sind mindestens 35.000 Kinder ohne Impfung [7]. Ziel des Masernaktionsplanes ist, dass 95% der Kinder bei Einschulung zweimal gegen Masern geimpft sind, auch das wird verfehlt.
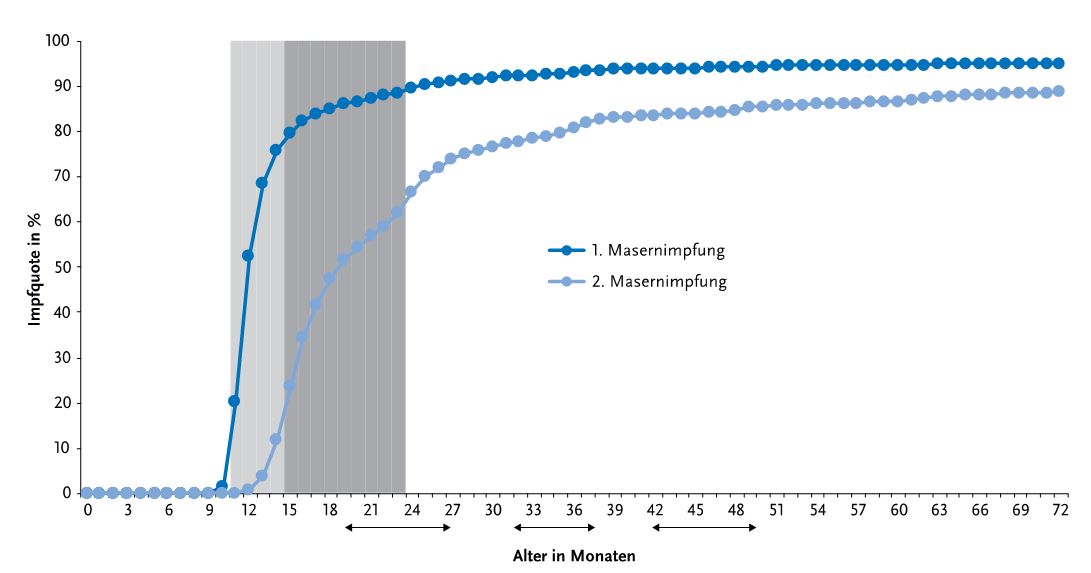
Abb. 4 Impfquote mit mindestens einer und zwei Masernimpfungen; Alter 0-72 Monate; Geburtsjahrgang 2012. Die grauen Bereiche zeigen die empfohlenen Impfalter an. aus [7]. Mit freundlicher Erlaubnis von T. Rieck, A. Siedler, RKI
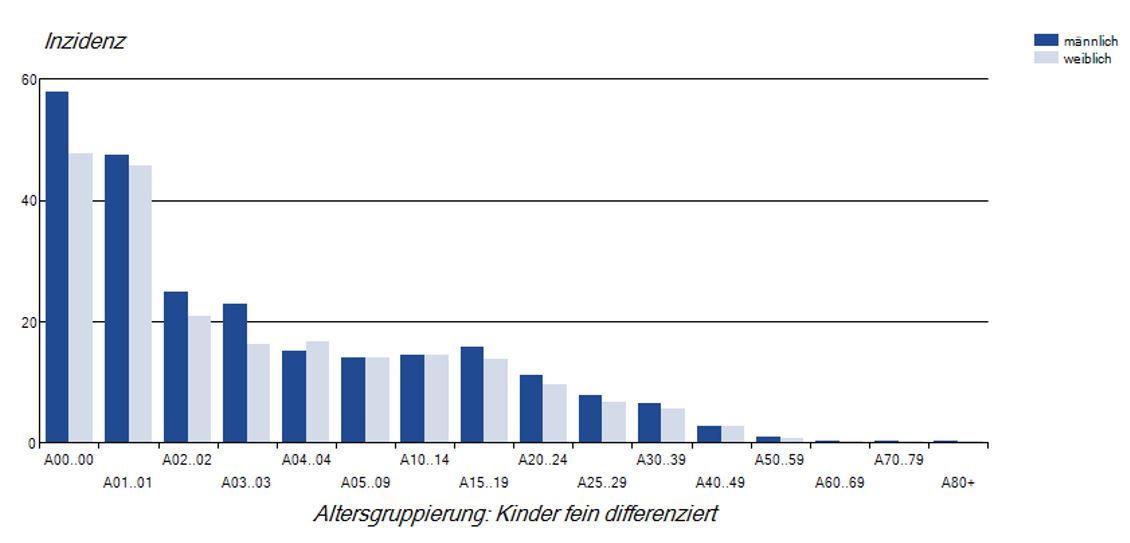
In den letzten 10 Jahren kam es immer wieder zu zeitlich begrenzten, regionalen bis bundesweiten Masernausbrüchen mit teilweise sehr hohen Fallzahlen. Dabei waren sehr viele Jugendliche und junge Erwachsene betroffen, bei denen eine ungenügende Immunität gegen Masern besteht. Am höchsten ist die Inzidenz bei Kindern unter zwei Jahren, siehe Abb. 5. Diese Fallzahlen begründen den dringenden Handlungsbedarf bei der Umsetzung der STIKO-Empfehlungen. Das gilt umso mehr, als dass ungeimpfte Kinder unter 11 Monaten, welche keine maternalen Masern-Antikörper mehr aufweisen, nur durch Herdenschutz in ihrer Umgebung indirekt vor Masern geschützt werden können. Kinder ab 11 Monaten müssen zeitgerecht und vollständig geimpft werden, um Infektionen in dieser Altersgruppe zu verhindern. Impflücken von älteren Kindern, Jugendlichen und Erwachsenen müssen dringend geschlossen werden, einerseits zum Schutz dieser Personen selbst und andererseits, um einen Gemeinschaftsschutz für Kinder im ersten Lebensjahr u.a. aufzubauen.
Abb. 5: Masernerkrankungen/100.000 Einwohner nach Alter und Geschlecht von 2015-2019. Robert Koch-Institut: SurvStat@RKI 2.0, https://survstat.rki.de, Abfragedatum: 29.08.2020
HPV (Humane Papillomaviren)
Die HPV-Impfung wird seit 2007 für Mädchen empfohlen, seit 2014 für das Alter von 9-14 Jahren mit der Möglichkeit der Nachholimpfung bis zum 18. Geburtstag. Seit 2018 wird die Impfung auch für Jungen im gleichen Alter empfohlen.
HP-Viren sind weit verbreitet. Meist bald nach Aufnahme der sexuellen Aktivität kommt es zu einer Infizierung. Dabei kann es zeitgleich zu einer Infektion mit mehreren HPV-Typen kommen. Meist sind es transiente Infektionen. Einige Typen können in der Schleimhaut/Haut persistieren und zu malignen Tumoren (insbes. Hochrisiko-Typen HPV 16 und 18) oder zu Genitalwarzen (v.a. HPV 6 und 11) führen [20].
Jährlich erkranken in Deutschland ca. 6.250 Frauen und ca. 1.600 Männer an HPV-bedingten Karzinomen im Bereich der Zervix, Vagina, Vulva, des Penis, am Anus und Oropharynx [21]. Es sterben etwa 1500 Frauen mit Zervixkarzinom in Deutschland pro Jahr. Die Zahl der Frauen mit Präkanzerosen an der Zervix (zervikale intraepitheliale Neoplasie) ist um ein Vielfaches höher. Viele dieser meist jungen Frauen erhalten eine Konisation, mit anschließend höherem Risiko für Frühgeburten.
Eine HPV-Impfung schützt sehr effektiv vor der Erstinfektion mit den im Impfstoff enthaltenen HPV-Typen. Populationsbezogene Studien zeigen eine Reduktion der Prävalenz von genitalen Infektionen mit den Hochrisikotypen, eine signifikante Reduktion der anogenitalen Warzen und eine signifikante Reduktion der Inzidenz von CIN2 bis zu invasiven Zervixkarzinomen nach Implementierung der Impfung und Impfraten von 50% oder mehr (Übersicht in [22] und [23]). Neue Langzeitdaten aus Schweden belegen ein erheblich gesunkenes Risiko für ein invasives Zervixkarzinom bei geimpften Frauen [24].
Die Effektivität der Impfung ist am höchsten vor einer ersten möglichen HPV-Infektion. Untersuchungen zur Dauer des Impfschutzes zeigen einen über viele Jahre bestehenden Schutz nach Impfung. Jugendliche zwischen 10 und 14 Jahren haben darüber hinaus höhere Antikörper-Antworten auf HPV-Impfung als ältere Jugendliche. Das waren Argumente, um 2014 den empfohlenen frühesten Impfzeitpunkt auf das Alter 9 Jahre vorzuziehen [25].
Angesichts der hohen präventiven Wirksamkeit der Impfstoffe und der seit weit über 10 Jahren bestehenden Impfempfehlung sind die Impfquoten nach wie vor zu niedrig. . Daten aus der KV-Impfsurveillance ergeben für 2018 eine bundesweite Impfquote für eine vollständige HPV-Impfquote bei 15-jährigen Mädchen von 43%, mit einer großen Spannweite (Kreisebene: 15,7%-76,9%) [7]. Mädchen unter 18 Jahren waren 2018 nur zu 51,1% vollständig geimpft. Von den 18-jährigen Frauen, die schon einmal geimpft wurden, hatten 19% die Impfserie nicht abgeschlossen. Es zeigt sich jedoch seit 2014 ein deutlicher Anstieg der Impfraten bei jüngeren Jugendlichen und Kindern, [7] und Abb. 6. Auch die Zahl der vollständigen Impfserien ist angestiegen.
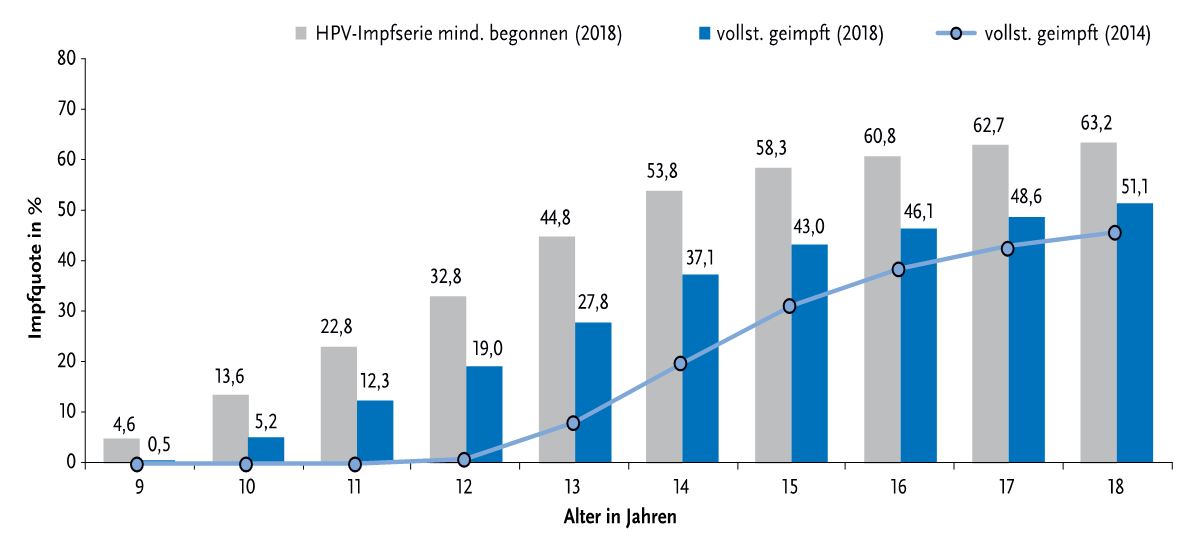
Abb. 6 HPV-Impfquote in Prozent bei Mädchen nach Alter. Dargestellt sind die Anteile mit begonnener und abgeschlossener HPV-Impfserie. Stand: Dezember 2014 vs. 2018. Bild aus [7] Mit freundlicher Genehmigung von T. Rieck, A. Siedler RKI.
Fazit: wahrscheinlich wirken sich das 2014 gesenkte Impfalter und das im Alter von 9 bis 14 Jahren auf 2 Impfdosen (ab Alter 15 Jahre: 3 Dosen) reduzierte Impfschema positiv auf die Impfraten aus. Auch sind die jüngeren Kinder ber Vorsorgeuntersuchungen besser erreichbar. Alles in allem ist die Inanspruchnahme der HPV-Impfung aber weiterhin gering. Die Abbruchrate ist hoch. Es gibt erhebliche regionale Unterschiede. Jüngere Kinder erhalten noch relativ selten eine Impfung in einem Alter, in dem die Effektivität der Impfung am höchsten ist. Verlässliche Impfquoten bei männlichen Jugendlichen in Deutschland sind noch nicht bekannt.
3. Gründe für zu spät erfolgende Impfungen
Gründe für eine verzögerte Impfteilnahme sind vielfältig (Tab. 3). Sie können in den Lebensverhältnissen der Familien oder in persönlichen Vorbehalten und Sorgen der Eltern liegen. Am wichtigsten sind die Einstellungen des impfenden Arztes.
Soziale und familienbezogene Gründe. Umzüge der Familien im frühen Kindesalter, häufige Wechsel der betreuenden Kinder- und Jugendärztlichen Praxis, Migration oder Flucht sind einige Gründe für eine verzögerte Inanspruchnahme von Impfungen [26]. Familien mit vielen Kindern oder hohen familiären Belastungen haben eher Schwierigkeiten ihre Termine zu organisieren. Eine wesentliche Rolle für die Änderung bei Impfquoten bei zugewanderten Kindern spielt unmittelbar die Zuwanderungsdynamik. So sinken die Impfquoten im Zusammenhang mit erhöhter Zuwanderung bei Einschulung von nicht in Deutschland geborenen Kindern seit 2012 kontinuierlich [27], [28]. Mangelnde Kenntnisse der deutschen Sprache gehen häufig mit einer verzögerten Impfteilnahme einher [27]. Damit werden die Barrieren hoch, einen Termin zur Impfung oder einen Folgetermin zu vereinbaren. Ein weiterer wichtiger Grund einer Verzögerung des Impfstartes bei jungen Säuglingen ist eine fehlende Krankenversicherung. Dann sind zwar manchmal subsidiär Impfungen im ÖGD möglich, aber das führt unweigerlich zur weiteren Verschiebung.
Persönliche Gründe. Die meisten impfpräventablen Erkrankungen sind weniger häufig als früher, somit oftmals nicht mehr sichtbar und damit sind deren Risiken nicht im Alltag präsent. Manche Eltern sorgen sich daher weniger um die zu vermeidenden Krankheiten sondern darum, ihr Kind schon in einem so jungen Alter impfen zu lassen oder sie haben Bedenken wegen banaler Infektionen oder Unpässlichkeiten und verschieben Impftermine [29], [30] [31]. Dabei spielt der Einfluss der Peergruppe und der Familie eine große Rolle [32], [33]. Eine fundierte Aufklärung der Eltern über Zweck von Impfungen im frühen Alter des Kindes ist daher sehr wichtig. Gerade die erste Impfung wird von Eltern als eine besorgniserregende Hürde angesehen [34]. Wie diese Impfung abläuft, wie die Eltern sich mit ihren Sorgen verstanden fühlen und wie sie die erste Impfung erleben bestimmt auf lange Zeit ihre weiteren Einstellungen zu Impfungen.
Kommunikation und Ablauf der ersten Impfung hat auf den möglichst vollständigen Impfschutz von Kindern in Deutschland einen wesentlich höheren Effekt als die Impflücken, die von wenigen Familien ausgehen, die einzelne oder alle Impfungen ablehnen.
Arztbezogene Faktoren. Die Primärversorger haben die Schlüsselrolle für eine zeitgerechte Teilnahme an Impfungen [35]. Die Einstellung des impfenden Arztes, die Organisation des gesamten Praxisablaufes und ein funktionierendes Impfmanagement, in das auch die Praxismitarbeiter eingebunden sind, sind entscheidend. Der Umgang mit falschen Kontraindikationen ist wichtig [31].
Meist werden eingespielte Praxisroutinen und Arbeitsabläufe die Impfzeitpunkte bestimmen. Vielfach erfolgen Vorsorgeuntersuchungen ohne das gleichzeitige Schließen von Impflücken. Auch andere Möglichkeiten zur Vervollständigung des Impfschutzes werden nicht ausreichend ausgeschöpft [36]. Oft werden im Praxisalltag von Ärzten/Ärztinnen oder MFAs anstehende Impfungen nicht aktiv angesprochen oder vergessen, an diese zu erinnern [37]. Impfungen werden nicht zeitgerecht angeboten, bei Bedenken der Eltern werden Kinder rasch als nicht impffähig eingestuft (falsche Kontraindikationen), Empfehlungen werden nicht beachtet, Impfstoffe werden off-label ohne Zulassung eingesetzt. Manche Ärzte lehnen einzelne bis hin zu allen Impfungen ab. Impfquoten und die Zeitpunkte für die Impfungen sind oft kleinräumig sehr unterschiedlich. Das hängt weniger mit den Einstellungen der Eltern als vielmehr mit denen der impfenden Ärzte zusammen. Deren Einstellungen sind eng mit den regionalen Impfquoten assoziiert [38].
|
Soziale und familienbezogene Faktoren |
persönliche Faktoren |
Arztbezogene Faktoren |
|
|
|
Tab. 3: Einflussfaktoren auf eine zeitgerechte Impfteilnahme
4. Ansatzpunkte, um zeitgerechte Inanspruchnahme von Impfungen zu unterstützen
Es gibt eine Reihe von Ansatzpunkten, um Kinder, insbesondere Säuglinge, zeitgerecht zu impfen [39].
2020 hat die STIKO mit dem neuen 2+1-Schema die Impfzeitpunkte eindeutig definiert, die Impfungen sollen mit 2, 4 und 11 Monaten erfolgen. Das gleiche gilt für die MMRV-Impfungen, die im Alter von 11 und 15 Monaten erfolgen sollen.
Die Abläufe in der Praxis sollen so geplant werden, dass routinemäßig Eltern die frühestmöglichen Impftermine erhalten und zeitgerechtes Impfen Standard ist. So kann etwa gleich bei der U3 (mit 4 Wochen) ein Impftermin für die 9. Lebenswoche vereinbart werden; oder der Termin für die U6 wird immer mit 11 Monaten (und gleichzeitigen Impfungen) ausgemacht. Ein Vorschlag findet sich in Tab. 4. Der Anteil zeitgerecht geimpfter Kinder sollte als wichtiger Qualitätsindikator in jeder Kinder- und Jugendarztpraxis eingeführt werden.
Das Impfen sollte in allen Altersgruppen einfach sein, mögliche Barrieren müssen identifiziert und abgebaut werden. So kann man z.B. für Schulkinder und Jugendliche Impfungen ohne vorherige Terminvereinbarung anbieten. Erinnerungssysteme sind sinnvoll (Recall, z.B. über die kostenlose PraxisApp „Mein Kinder- und Jugendarzt“ des BVKJ). Die Praxis-EDV sollte zur Bestimmung der praxisspezifischen Impfraten und Impfzeitpunkte in der Lage sein. Das ist auch eine wichtige Anwendungsoption für die künftige elektronische Patientenakte verbunden mit dem elektronischen Impfausweis.
Alle Mitarbeiter der Praxis sollen die Impfzeitpunkte kennen, die Impfausweise kontrollieren und selbständig Eltern auf fehlende oder ausstehende Impfungen ansprechen. Dazu ist ein Wissen über falsche Kontraindikationen wichtig, etwa Schnupfen und Husten, siehe dazu die Ausführungen der STIKO [1] und der DAKJ-Kommission für Infektionskrankheiten und Impffragen[31]. Jeder Arztbesuch sollte zur Vervollständigung des Impfschutzes genutzt werden: Wird ein Kind beispielsweise mit einem banalen Infekt oder für Reise-, Sport- oder andere Bescheinigungen in der Praxis vorgestellt, kann man bei der Gelegenheit prüfen, ob Impfungen anstehen und diese möglichst sofort anbieten. Erkannte Impflücken können damit geschlossen werden. Alle Vorsorgeuntersuchungen sollen zur Überprüfung des Impfstatus, zur Impfberatung und zum Ergänzen von Impfungen genutzt werden.
Die Primärversorger sind die wichtigsten Ansprechpartner und Berater für Familien in allen gesundheitlichen Dingen, insbesondere zu Fragen um alle Impfungen. Beim Gespräch mit den Eltern ist eine vertrauensvolle Atmosphäre wichtig [34], [40]. Es dient der Aufklärung zu den Risiken durch impfpräventable Erkrankungen, den Zielen von zeitgerechten Impfungen, der Auflösung von Mythen und unterstützt die Entscheidungsfindung der Eltern. Kinder mit banalen Infektionen, subfebrilen Temperaturen (<38,5°C) und in gutem Allgemeinzustand können geimpft werden. Für die Aufklärung der Eltern ist wichtig, dass unter diesen Umständen kein zusätzlicher Schaden entstehen kann, keine verstärkten Nebenwirkungen zu befürchten sind und auch die Wirksamkeit der Impfung nicht beeinträchtigt ist [40].
Ein guter Zeitpunkt für die Komplettierung von Impfserien ist die Aufnahme des Kindes in eine Kindertageseinrichtung. Gemäß IfSG § 36 10; 10a müssen Eltern bei Aufnahme des Kindes die Bescheinigung einer altersgerechten Impfberatung vorlegen. Somit ist ein Arztgespräch und damit die Möglichkeit eines Impftermins auch „außer der Reihe“ in dem Alter sichergestellt, in dem die Exposition zu Infektionserregern durch Aufnahme in die Gemeinschaftsbetreuung erheblich steigt.
Bei Jugendlichen führt die Teilnahme an der J1 zu einer eindeutigen Erhöhung der Teilnahme an der HPV-Impfung [41]. Aber auch andere Maßnahmen sind erforderlich: der Zugang zu den Impfungen muss sehr einfach und unkompliziert sein, z.B. kann man Impfungen ohne Vortermin für Schulkinder anbieten (einfache Maßnahme, sehr effektiv) oder Impfprojekte in Schulen organisieren (aufwendig).
Einige regionale Maßnahmen können ebenfalls die Impfteilnahme beeinflussen: im ÖGD sind aufgrund der Daten aus den Einschulungsuntersuchungen die Impfraten kleinräumig bekannt. In gemeinsamen Treffen mit ÖGD und Praxen können diese vorgestellt und diskutiert werden.
Sinnvoll sind auch regionale Fortbildung und Treffen mit den Hebammen und den Fachkräften der Frühen Hilfen. Projekte mit Impfinformationen für werdende Eltern in Geburtskliniken oder vor Geburt in Schwangerschaftsvorbereitung können hilfreich sein [42].
|
Alter |
Vorsorge |
Impfung |
|
|
Neugeborenes |
U1, U2 |
Indikationsimpfung: Hepatitis B |
Haushaltsmitglieder: Impfstatus prüfen und gegebenenfalls ergänzen: MMR, Pertussis |
|
4 Wo |
U3 |
Haushaltsmitglieder impfen, falls noch nicht geschehen Impftermin vereinbaren |
|
|
2 Monate |
(U4) |
1. DTPa-HepB-Hib-IPV, Pneumokokken- und Rotavirus-Impfungen |
Haushaltsmitglieder impfen, falls noch nicht geschehen |
|
3 Monate |
U4 |
2. Rotavirus-Impfung |
|
|
4 Monate |
2. DTPa-HepB-Hib-IPV -und Pneumokokken-Impfung (Rota) |
||
|
11 Monate |
U6 |
3. DTPa-HepB-Hib-IPV -und Pneumokokken |
Mindestabstand beachten* |
|
11 Monate |
1.MMR/Varizellen |
||
|
(14)-15 Monate |
2. MMRV; MenC |
Mindestabstand beachten** |
|
|
5 Jahre |
U 9 |
TdaP |
|
|
5-6 Jahre Schuleingangsuntersuchung ÖGD |
Schuleingangs-untersuchung |
Überprüfung und Beratung des Impfstatus des Einschulkindes und der Eltern, ggfs. Impfangebot |
|
|
9 Jahre |
U 11 |
HPV |
2x; Abstand 6 Monate |
|
12 Jahre |
J1 |
TdaP-IPV |
Fehlende Impfungen ergänzen |
|
17 Jahre |
J2 |
|
Fehlende Impfungen ergänzen |
Bei allen Vorsorgeuntersuchungen U4-J2 sollen Impfausweise überprüft und fehlende Impfungen nachgeholt werden!
* zwischen der 2. und 3. DTPa-HepB-Hib-IPV -und Pneumokokken-Impfung sollten mindestens 6 Monate liegen
** Die zweite MMR-V kann frühestens 4 Wochen nach der ersten gegeben werden.
Tab. 4: Koordinierung von Impfterminen und Vorsorgeuntersuchungen – Ein Praxisbeispiel
Stellungnahme der Kommission
In dieser Stellungnahme werden verfügbare Daten zu Impfzeitpunkten bei Standardimpfungen von Kindern und Jugendlichen dargelegt. Bei den meisten dieser Impfungen sind die Impfquoten zwar zum Zeitpunkt der Einschulung auf einem befriedigenden Niveau. Bei allen Impfungen sieht man jedoch, dass die empfohlenen Alterszeitpunkte bei einer großen Zahl von Kindern nicht eingehalten werden, die Impfungen verzögert erfolgen und Impfserien oft nicht im empfohlenen Zeitrahmen abgeschlossen werden. Einige Kinder erhalten manche Impfungen gar nicht. Das hat vielschichtige Konsequenzen.
- Durch eine verspätet einsetzende Grundimmunisierung sind junge Kinder einer erhöhten Infektionsgefahr ausgesetzt. Das ist kein theoretisches Risiko, wie die hohen Fallzahlen von Pertussis und Masern insbesondere bei jungen Kindern demonstrieren.
- Unvollständige Impfserien führen zu einem unzureichenden Schutz und können oft nicht oder nur mit geringerer Effektivität nachgeholt werden, so etwa bei Rotaviren, Pneumokokken und HPV. Auch hier ist die Folge ein ungenügender Impfschutz und eine hohe Krankheitslast auf Bevölkerungsebene.
- Das Potential einer HPV-Impfung wird nicht ausgeschöpft, wenn die Impfung zu spät gegeben wird, in einem Alter, in dem bei einigen Jugendlichen schon Infektionen aufgetreten sind.
- Internationale Anstrengungen zur Elimination oder Eradikation von Erregern (Masern, Polio) werden durch niedrige Impfquoten unterlaufen. Diese haben, da meist internationale und nationale Zielvereinbarungen bestehen, damit auch internationale Konsequenzen.
Impfquoten und die Impfzeitpunkte sind oft lokal sehr unterschiedlich. Hier ist eine regionale Analyse und Diskussion notwendig. Dies hängt weniger mit den Einstellungen der Eltern als vielmehr mit denen der impfenden Ärzte zusammen. Deren Einstellungen sind eng mit den lokalen Impfquoten assoziiert [38].
Niedrige Impfquoten oder verspätete Impfungen in kleinen Regionen führen lokal zu einem reduzierten Gemeinschaftsschutz und können Ausgangspunkte für größere Ausbrüche, etwa mit Masern oder Pertussis sein.
Die zeitgerechte Umsetzung von Impfempfehlungen schützt den Einzelnen und sorgt für eine bestmögliche Vermeidung impfpräventabler Erkrankungen in der Bevölkerung. Diesen Konsens in der Ärzteschaft dauerhaft und auch regional sicherzustellen ist eine notwendige Aufgabe der ärztlichen Selbstverwaltung.
Die übliche Impfroutine in den Praxen muss überdacht werden und dringend besser an die Empfehlungen angepasst werden. Die Barrieren für die Teilnahme an einer Impfung sollten niedrig sein, Impftermine auch unabhängig von anderen Terminen angeboten werden.
Alle am Impfprozess Beteiligten, etwa Praxismitarbeiter/-innen und Arzt/Ärztin sollen mögliche Impfhindernisse, wie etwa falsche Kontraindikationen, kennen und entsprechend fundiert adressieren können.
Das Gespräch mit den Eltern soll in einer vertrauensvollen Atmosphäre stattfinden, den Sinn frühzeitiger Impfungen erläutern und über Mythen aufklären.
Jugendliche müssen direkt angesprochen werden. Für sie sind besondere Maßnahmen erforderlich, um die Rate an HPV-Impfungen sowie das Bewusstsein für einen vollständigen Impfschutz (Nachhol- und regelmäßige Auffrischimpfungen) zu steigern, wie z.B. das Angebot von Vorsorgeuntersuchungen (U 11, J1) und ein unkomplizierter Zugang zu den Impfungen.
Eine regionale Kooperation mit dem ÖGD zur Diskussion der aktuellen regionalen Impfquoten kann ein wirksames Mittel sein, die zeitgerechte Teilnahme zu verbessern.
In den Praxen sollen praxisspezifische Impfzeitpunkte und Impfraten als Qualitätsindikatoren erfasst werden.

Kommission für Infektionskrankheiten und Impffragen der Deutschen Akademie für Kinder- und Jugendmedizin
Prof. Dr. U. Heininger, Basel (Sprecher der Kommission), Dr. H. Grundhewer, Berlin (federführend), Prof. Dr. Markus Knuf, Wiesbaden, Dr. Axel Iseke, Münster, Prof. Dr. C. Korenke, Oldenburg, Prof. Dr. A. Müller, Bonn, Dr. med. U. von Both, München.
Korrespondenzadresse:
Deutsche Akademie für Kinder- und Jugendmedizin e.V. Prof. Dr. med. Hans-Iko Huppertz, Generalsekretär
Chausseestr. 128/129, 10115 Berlin
Tel.: 030.4000588-0, Fax.: 030.4000588-88
e-Mail: kontakt@dakj.de
Eine Kurzfassung dieser Stellungnahme finden Sie unter
www.buendnis-kjg.de/stellungnahmen/informationen-fuer-eltern/zeitgerechtes-impfen-kinder-jugendliche
Literatur
[1] Ständige Impfkommission (STIKO) beim Robert Koch-Institut, „Empfehlungen der Ständigen Impfkommission beim Robert Koch-Institut – 2020/2021“, 2020, doi: 10.25646/7083.
[2] Robert Koch-Institut, Infektionsepidemiologisches Jahrbuch meldepflichtiger Krankheiten für 2019 Datenstand: 1. März 2020. Berlin, 2020.
[3] U. Heininger, „Pertussis (Keuchhusten)“, Monatsschr Kinderheilkd, Bd. 168, Nr. 8, S. 747–759, Aug. 2020, doi: 10.1007/s00112-020-00941-9.
[4] D. Matysiak-Klose, „Hot Spot: Epidemiologie der Masern und Röteln in Deutschland und Europa“, Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz, Bd. 56, Nr. 9, S. 1231–1237, Aug. 2013, doi: 10.1007/s00103-013-1799-x.
[5] Robert Koch-Institut, „Berliner Masernausbruch 2014/2015 – Stationär im Otto-Heubner-Centrum für Kinder- und Jugendmedizin der Charité behandelte Patienten“, Epidemiologisches Bulletin, Nr. 47/48, S. 499–506, 2015, doi: 10.17886/EPIBULL-2015-018.
[6] A. Siedler und T. Rieck, „Erhebung von Impfquoten im Kindes- und Jugendalter in Deutschland – Die RKI Impfsurveillance und ihr neues Publikationsformat“, Juli 2020, doi: 10.25646/7020.
[7] T. Rieck, M. Feig, O. Wichmann, und A. Siedler, „Impfquoten von Kinderschutzimpfungen in Deutschland – aktuelle Ergebnisse aus der RKI-Impfsurveillance“, Juli 2020, doi: 10.25646/7027.
[8] „European Vaccine Action Plan 2015-2020“, S. 108.
[9] J. Liese, „Pertussis bei Jugendlichen und Erwachsenen: Aktueller Stand der Impfprävention“, Monatsschrift Kinderheilkunde, Bd. 153, Nr. 9, S. 845–853, Sep. 2005, doi: 10.1007/s00112-005-1218-y.
[10] A. Kunze, N. Laping, A. von Knoop, und M. Knuf, „Pertussis mit Hyperleukozytose bei jungen Säuglingen: Gefahr einer lebensbedrohlichen Infektionskrankheit“, Monatsschrift Kinderheilkunde, Apr. 2019, doi: 10.1007/s00112-019-0696-2.
[11] A. Schielke, A. Takla, R. von Kries, O. Wichmann, und W. Hellenbrand, „Marked Underreporting of Pertussis Requiring Hospitalization in Infants as Estimated by Capture-Recapture Methodology, Germany, 2013-2015“, Pediatr. Infect. Dis. J., Bd. 37, Nr. 2, S. 119–125, 2018, doi: 10.1097/INF.0000000000001698.
[12] AG 6-fach-Impfung (DTaP-IPV-Hib-HepB) der Ständigen Impfkommission (STIKO), „Wissenschaftliche Begründung für die Empfehlung zur Grundimmunisierung gegen Diphtherie, Tetanus, Pertussis, Poliomyelitis, Haemophilus influenzae Typ b und Hepatitis B mit dem 6-fach-Impfstoff im Säuglingsalter nach dem 2+1-Impfschema“, Epidemiologisches Bulletin, Nr. 26, S. 3–21, Juni 2020, doi: 10.25646/6955.
[13] C. H. Wirsing von König, „Pertussis-Komplikationen bei Kindern und Jugendlichen (1.1.1997-31.12.2000)“. 2016, [Online]. Verfügbar unter: http://www.esped.uni-duesseldorf.de/esped/resources/files/Pertussis1997-2000%20WvKoenig.pdf.
[14] I. Mack, T. E. Erlanger, P. Lang, P. Sinniger, D. Perisa, und U. Heininger, „Dose-dependent effectiveness of acellular pertussis vaccine in infants: A population-based case-control study“, Vaccine, Bd. 38, Nr. 6, S. 1444–1449, Feb. 2020, doi: 10.1016/j.vaccine.2019.11.069.
[15] STIKO, „Zusätzliche Pertussis-Impfung im Erwachsenenalter als Tdap- Kombinationsimpfung bei der nächsten fälligen Td-Impfung – Empfehlung und Begründung“, Epidemiologisches Bulletin, Nr. 31, S. 299–311, 2009.
[16] STIKO, „Erweiterung der beruflichen Indikationen für eine Pertussis-Impfung“, Epidemiologisches Bulletin, Nr. 31, S. 311–313, 2009.
[17] AG Pertussis der Ständigen Impfkommission (STIKO), „Wissenschaftliche Begründung für die Empfehlung der Pertussisimpfung mit einem Tdap-Kombinationsimpfstoff in der Schwangerschaft“, Epidemiologisches Bulletin, Nr. 14, S. 3–34, März 2020, doi: 10.25646/6584.
[18] Robert Koch-Institut, „VacMap“. http://www.vacmap.de.
[19] Bundesministerium für Gesundheit, „Nationaler Aktionsplan 2015–2020 zur Elimination der Masern und Röteln in Deutschland“. 2015, [Online]. Verfügbar unter: https://www.bundesgesundheitsministerium.de/fileadmin/Dateien/5_Publikationen/Gesundheit/Broschueren/Aktionsplan_Masern_Roeteln.pdf.
[20] Robert Koch-Institut, „RKI-Ratgeber Humane Papillomviren“, Epidemiologisches Bulletin, Nr. 27, S. 255–259, 2018, doi: 10.17886/EPIBULL-2018-033.
[21] Zentrum für Krebsregisterdaten im Robert Koch-Institut und Robert Koch-Institut, Hrsg., Krebs in Deutschland für 2015/2016, Bd. 12. Berlin, 2019.
[22] AWMF, „Impfprävention HPV-assoziierter Neoplasien S3 Leitlinie -Langfassung- Register Nr.: 082-002“, 2020. Zugegriffen: Aug. 20, 2020. [Online]. Verfügbar unter: https://www.awmf.org/leitlinien/detail/ll/082-002.html.
[23] V. Osmani und S. J. Klug, „HPV-Impfung zur Prävention von Genitalwarzen und Krebsvorstufen – Evidenzlage und Bewertung“, Bundesgesundheitsbl, Apr. 2021, doi: 10.1007/s00103-021-03316-x.
[24] J. Lei u. a., „HPV Vaccination and the Risk of Invasive Cervical Cancer“, N Engl J Med, Bd. 383, Nr. 14, S. 1340–1348, Okt. 2020, doi: 10.1056/NEJMoa1917338.
[25] AG HPV der Ständigen Impfkommission (STIKO), Takla, A., M. Wiese-Posselt, T. Harder, und O. Wichmann, „Wissenschaftliche Begründung für die Empfehlung der HPV-Impfung für Jungen im Alter von 9 bis 14 Jahren“, Epidemiologisches Bulletin, Bd. 26, S. 233–250, 2018, doi: 10.17886/EpiBull-2018-032.
[26] C. Poethko-Müller, R. Kuhnert, S. Gillesberg Lassen, und A. Siedler, „Durchimpfung von Kindern und Jugendlichen in Deutschland: Aktuelle Daten aus KiGGS Welle 2 und Trends aus der KiGGS-Studie“, Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz, Bd. 62, Nr. 4, S. 410–421, Apr. 2019, doi: 10.1007/s00103-019-02901-5.
[27] S. Bettge und S. Oberwöhrmann, „Grundauswertung der Einschulungsdaten in Berlin 2017. Gesundheitsberichterstattung Berlin“. 2018, [Online]. Verfügbar unter: https://www.berlin.de/sen/gesundheit/_assets/service/ publikationen/gesundheitsberichterstattung/veroeffentlichungen/ grundauswertungen/2019-02-18-grundauswertung_esu_2017_endfas- sung.pdf.
[28] O. Wichmann, „Der Europäische Impfaktionsplan – Ziele und Strategien“, in Nationale Impfkonferenz 6 2019: Impfstrategien im Kontext internationaler Herausforderungen, Behörde für Gesundheit und Verbraucherschutz der Freien und Hansestadt Hamburg und Ministerium für Soziales, Gesundheit, Jugend, Familie und Senioren des Landes Schleswig-Holstein, Hrsg. Hamburg, 2019, S. 16–23.
[29] N. Horstkötter, U. Müller, und O. Ommen, Einstellungen, Wissen und Verhalten von Erwachsenen und Eltern gegenüber Impfungen – Ergebnisse der Repräsentativbefragung 2016 zum Infektionsschutz. Köln: Bundeszentrale für gesundheitliche Aufklärung, 2017.
[30] C. Betsch und K. Sachse, „Debunking vaccination myths: Strong risk negations can increase perceived vaccination risks.“, Health Psychology, Bd. 32, Nr. 2, S. 146, 2013.
[31] P. Bartmann u. a., „Banale Infektionen – keine Kontraindikation für Impfungen“, Monatsschr Kinderheilkd, Bd. 161, Nr. 8, S. 735–737, Aug. 2013, doi: 10.1007/s00112-013-2955-y.
[32] C. Betsch, C. Ulshöfer, F. Renkewitz, und T. Betsch, „The Influence of Narrative v. Statistical Information on Perceiving Vaccination Risks“, Med Decis Making, Bd. 31, Nr. 5, S. 742–753, Sep. 2011, doi: 10.1177/0272989X11400419.
[33] C. Betsch, „Die Rolle des Internets bei der Elimination von Infektionskrankheiten: Zum Management von Wahrnehmungen und Fehlwahrnehmungen“, Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz, Bd. 56, Nr. 9, S. 1279–1286, Aug. 2013, doi: 10.1007/s00103-013-1793-3.
[34] C. Betsch, B. Bödeker, P. Schmid, und O. Wichmann, „How baby’s first shot determines the development of maternal attitudes towards vaccination“, Vaccine, Bd. 36, Nr. 21, S. 3018–3026, Mai 2018, doi: 10.1016/j.vaccine.2018.04.023.
[35] J. Kaufman u. a., „Face-to-face interventions for informing or educating parents about early childhood vaccination“, Cochrane Database of Systematic Reviews, Mai 2018, doi: 10.1002/14651858.CD010038.pub3.
[36] K. Simon, B. Borrmann, A. Iseke, und S. Thole, „Kompletter Impfschutz zum Zeitpunkt der Einschulungsuntersuchung unter Berücksichtigung der Teilnahme an der U9, Nordrhein-Westfalen, 2016/2017“, in NIK 6 2019 Impfstrategien im Kontext internationaler Herausforderungen, Behörde für Gesundheit und Verbraucherschutz der Freien und Hansestadt Hamburg und Ministerium für Soziales, Gesundheit, Jugend, Familie und Senioren des Landes Schleswig-Holstein, Hrsg. Hamburg, 2019, S. 125–126.
[37] C. J. Klett-Tammen, G. Krause, T. von Lengerke, und S. Castell, „Advising vaccinations for the elderly: a cross-sectional survey on differences between general practitioners and physician assistants in Germany“, BMC Family Practice, Bd. 17, Nr. 1, Dez. 2016, doi: 10.1186/s12875-016-0502-3.
[38] M. Weigel, K. Weitmann, C. Rautmann, J. Schmidt, R. Bruns, und W. Hoffmann, „Impact of physicians’ attitude to vaccination on local vaccination coverage for pertussis and measles in Germany“, Eur J Public Health, Bd. 24, Nr. 6, S. 1009–1016, Dez. 2014, doi: 10.1093/eurpub/cku013.
[39] C. Betsch, C. Breuer, J. Hacker, K. Happe, und M. Hecker, Gemeinsam Schutz aufbauen. Verhaltenswissenschaftliche Optionen zur stärkeren Inanspruchnahme von Schutzimpfungen. Halle (Saale), 2019.
[40] C. Betsch, E. von Hirschhausen, und V. Zylka-Menhorn, „Impfberatung in der Praxis: Professionelle Gesprächsführung: wenn Reden Gold wert ist“, Dtsch Arztebl International, Bd. 116, Nr. 11, S. A-520-7, 2019.
[41] T. Rieck, M. Feig, Y. Deleré, und O. Wichmann, „Utilization of administrative data to assess the association of an adolescent health check-up with human papillomavirus vaccine uptake in Germany“, Vaccine, Bd. 32, Nr. 43, S. 5564–5569, Sep. 2014, doi: 10.1016/j.vaccine.2014.07.105.
[42] A. Gagneur u. a., „A postpartum vaccination promotion intervention using motivational interviewing techniques improves short-term vaccine coverage: PromoVac study“, BMC Public Health, Bd. 18, Nr. 1, Dez. 2018, doi: 10.1186/s12889-018-5724-y.