Stellungnahme der Kommission für Infektionskrankheiten und Impffragen
vom 31. März 2022
Hier die Stellungnahme im PDF-Format.
Meningokokken sind gramnegative Bakterien der Art Neisseria meningitidis. Es sind zwölf Serogruppen unterscheidbar, wobei in der Bundesrepublik Deutschland etwa zwei Drittel der Fälle an invasiven Infektionen durch die Serogruppe B (MenB) und ca. 15 % aller Fälle durch die Serogruppe C verursacht werden. Die Übertragung erfolgt durch Tröpfcheninfektion. Screeninguntersuchungen zeigen, dass bei ca. 10 % gesunder Personen eine Besiedlung der Schleimhäute im Nasen-Rachen-Raum mit Meningokokken nachweisbar ist. Bei Jugendlichen werden Kolonisationsraten bis 25 % gefunden. Nur in Ausnahmefällen führt eine Besiedlung zu einer invasiven Erkrankung. Durch die Besiedlung werden bakterizide Antikörper induziert, die sowohl vor erneuter Besiedlung mit dem gleichen molekulargenetischen Feintyp als auch vor invasiver Erkrankung schützen können. Invasive Erkrankungen werden durch unspezifische Schädigungen der Schleimhäute begünstigt. Besonders gefährdet sind Personen mit Immundefekten, insbesondere bei Komplementdefekten, oder Asplenie.
Klinisch äußert sich die invasive Meningokokken-Infektion in Form einer Meningitis und/oder einer Sepsis. Das Spektrum schließt sowohl asymptomatische Bakteriämien als auch foudroyante septische Verläufe ein, die innerhalb weniger Stunden zum Tod führen können (Purpura fulminans, Waterhouse-Friderichsen-Syndrom).
Epidemiologie in Deutschland
In den Jahren 2016 bis 2019 (http://www.meningococcus.uni-wuerzburg.de) wurden jährlich 227 bis 282 Fälle invasiver Meningokokkenerkrankungen an das Robert Koch-Institut gemeldet. Davon waren die meisten (ca. 60 %) durch Serogruppe B ausgelöst, was im Vergleich zu den Jahren 2012-2017 (https://www.dakj.de/stellungnahmen/impfprophylaxe-invasiver-erkrankungen-mit-meningokokken-der-serogruppe-b/) einen leichten Rückgang darstellt (Tabelle 1) [1]. Interessant ist der deutliche Rückgang der invasiven Meningokokken-Infektionen um nochmals die Hälfte im Jahr 2020. Dies wird erklärt durch die Präventionsmaßmaßnahmen wie Abstands- und Hygiene Regeln zur Eindämmung der COVID-19 Pandemie.
Die Gesamtinzidenz der invasiven Meningokokken-Infektionen hat sich mit 0,31 pro 100.000 Einwohner im Jahr 2019 im Vergleich zum Jahr 2016 mit 0,41 pro 100.000 weiter reduziert, womit sich der abfallende Trend seit dem Jahr 2004 fortsetzt. Eingeschränkt verwertbar und beurteilbar ist die weitere Reduktion der Inzidenz im Jahr 2020 auf 0.17/100.000 Einwohner, da dies wahrscheinlich auf die außergewöhnlichen Hygienemaßnahmen zurückzuführen ist und keinen allgemeinen Trend darstellen wird. Weiterhin betreffen 20-30 % der gemeldeten Fälle Kinder unter fünf Jahren. Mit einer mittleren jährlichen Inzidenz von 2.8 Erkrankungen pro 100.000 Einwohner tritt die invasive Meningokokken-Infektion am häufigsten bei Kindern unter einem Jahr auf. Im Alter von 15 bis 19 und 20 bis 24 Jahren werden weitere Erkrankungsgipfel mit einer Inzidenz von 0.5 bzw. 0.6 pro 100.000 beobachtet. Danach sinkt sie weiter ab und beträgt bei älteren Erwachsenen noch 0,2 pro 100.000 (Zahlen für das Jahr 2019)[1, 2].
Tabelle 1: Meningokokken-Erkrankungen nach Altersgruppen 2016 – 2020 (https://www.hygiene.uni-wuerzburg.de/meningococcus/startseite/berichte/berichte-meningokokken)
|
Altersgruppe |
2016 |
2017 |
2018 |
2019 |
2020 |
|
< 1 Jahr (Serogruppe B in %) |
37 (83.8) |
32 (71.9) |
29 (89.7) |
23 (78.3) |
16 (93.7) |
|
1-4 Jahre (Serogruppe B in %) |
38 (86.8) |
32 (78.1) |
24 (87.5%) |
29 (93.1) |
18 (77.8) |
|
5-14 Jahre (Serogruppe B in %) |
18 (66.7) |
12 (83.3) |
19 (79) |
14 (85.7) |
9 (88.9) |
|
15-19 Jahre (Serogruppe B in %) |
51 (56.9) |
23 (56.5) |
27 (51.9) |
22 (59.1) |
8 (50.0) |
|
>20 Jahre (Serogruppe B in %) |
138 (41.3) |
132 (47.7) |
136 (36.8) |
139 (46.8) |
54 (33.3) |
|
Gesamt (Serogruppe B in %) |
282 (57.4) |
231 (58.0) |
235 (53.6) |
227 (59.5) |
105 (56.2) |
Die invasive Erkrankung verlief in 60 % (n=117) der 196 gemeldeten bzw. auswertbaren Fälle im Jahr 2019 als Meningitis, in 75 % (n=147) als Sepsis und bei 35 % (n=68) der Fälle wurde eine Sepsis mit Meningitis beobachtet. Etwa ein Viertel der auswertbaren invasiven Meningokokken-Infektionen (n=196) zeigte das fulminante Krankheitsbild einer Purpura fulminans (n=12, 6%) oder eines Waterhouse-Friderichsen-Syndroms (n=33, 17%) [1, 2].
Im Jahr 2019 verstarben 10 % der Patienten an den Folgen einer invasiven Meningokokken-Erkrankung. Damit war die Mortalität im Vergleich zu den Vorjahren unverändert. Bei einer Infektion mit Serogruppe C lag die Letalität in allen Altersgruppen mit 15 % höher als bei Erkrankungen durch Serogruppe B mit etwa 6% [2].
Rekurrierende invasive Meningokokken-Infektionen
Rekurrente invasive Meningokokken-Infektionen wurden als Einzelfallberichte in der Literatur beschrieben und in einer aktuellen Arbeit für den Zeitraum 2002 bis 2018 für Deutschland ausgewertet [3]. Risikofaktoren scheinen Komplementdefekte, bestimmte Lymphomerkrankungen (M. Waldenström) sowie IgG2- Subklassendefekte zu sein [4, 5]. Insgesamt zeigte sich, dass das Risiko nach einer Meningokokken-Infektion erneut zu erkranken um das 50-fache erhöht ist [3].
In dem oben genannten Zeitraum wurden 5.854 Fälle invasiver Meningokokken-Infektionen analysiert und das mediane Alter lag bei 9.4 Jahren (IQR: 3.9-13.7 Jahren). Bei 13 Fällen wurden 2 Episoden und bei einem Patienten 3 Episoden identifiziert. Das mediane Intervall von der ersten zur zweiten Erkrankung lag bei 19.9 Monaten (IQR: 11.7-36.1 Monate). 10 der 14 Patienten mit rekurrierenden Meningokokken-Infektionen waren jünger als 18 Jahre. Bei 5 der 14 Patienten wurde Serogruppe B identifiziert, 4 der 5 Patienten wurde auch bei der zweiten Episode Serogruppe B, allerdings mit einem anderen Subtyp nachgewiesen. Bei allen anderen Infektionen wurde bei der zweiten bzw. der dritten rekurrierenden Infektion eine jeweils andere Serogruppe nachgewiesen. Im Vergleich zu singulären invasiven Meningokokken-Infektionen wurden bei rekurrierenden Infektionen die in Deutschland häufigsten Serogruppen B und C signifikant seltener gefunden [3].
Die Gesamt- Inzidenz für rekurrierende invasive Meningokokken-Infektionen lag bei 29.4 (IQR: 29.3-29.5) pro 100.000 Personenjahre der Überlebenden der ersten Episode und war am höchsten im ersten (74.8 pro 100.000) und im zweiten Jahr (101.2 pro 100.000) nach der initialen Erkrankung. Verglichen mit der Gesamt- Inzidenz der invasiven Meningokokken-Infektionen von 0.54 pro 100.000 Personenjahre im untersuchten Zeitraum lag das relative Risiko für eine rekurrierende invasive Meningokokken-Infektion bei 52.5 (IQR: 52.3-52.7). Die multivariate Modellanalyse ergab eine noch höhere mediane Inzidenz von 39.1 (IQR: 35.2-43.1) pro 100.000 Personenjahre und ein relatives Risiko von 69.7 (IQR: 62.9-76.9) [3].
Prävention rekurrierender invasiver Meningokokken-Infektionen
Grundsätzlich können zwei Wege diskutiert werden, um rekurrierende invasive Meningokokken-Infektionen zu verhindern.
Eine Möglichkeit besteht im generellen Screening aller überlebender Patienten mit invasiver Meningokokken-Infektion auf Komplementdefekte und Impfung bei nachgewiesenem Komplementdefekt. Bei Berücksichtigung, dass nur bei der Hälfte der rekurrierenden invasiven Meningokokken-Infektionen überhaupt ein Komplementdefekt nachgewiesen wird, müssen 1.818 Fälle gescreent (number needed to screen) werden, um einen Fall einer rekurrierenden Infektion durch Impfung zu verhindern [3].
Die zweite Möglichkeit ist die generelle Impfung aller Patienten mit durchgemachter invasiver Meningokokken-Infektion. Die Kalkulation der Serotypen Abdeckung durch Impfungen gegen Meningokokken B (Bexsero®, Trumenba®) und Meningokokken A, C, W, Y (Menveo®, Nimenrix®, MenQuadfi®) lag bei 78% (Berechnung siehe Originalpublikation [3]). Daraus ergab sich eine Number needed to vaccinate (NNV) von 909 (Berechnung siehe Originalpublikation), um einen Fall einer rekurrierenden Infektion im ersten Jahr nach initialer invasiver Meningokokken-Infektion zu verhindern [3].
Impfstoffe (Siehe auch Stellungnahme der Kommission 2018) [6]
Anfang 2013 wurde der Impfstoff Bexsero® (4CMenB) für die aktive Immunisierung von Personen im Alter ab zwei Monaten gegen invasive Meningokokken-Erkrankungen durch Neisseria meningitidis der Gruppe B zugelassen und ist seit Dezember 2013 in Deutschland verfügbar. Der Impfstoff enthält drei rekombinant hergestellte Proteine von Neisseria meningitidis der Gruppe B, nämlich das NHBA-Fusionsprotein (Neisseria-Heparin bindendes Antigen), das NadA-Protein (Neisseria Adhäsin A) und das fHbp-Fusionsprotein (Faktor H- bindendes Protein) sowie Vesikel der äußeren Membran (outer membrane vesicle, OMV) vom Stamm NZ98/254. Alle Antigene sind an Aluminiumhydroxid adsorbiert. Die Zusammensetzung dieses Impfstoffes erfasst nicht alle zirkulierenden Stämme der Serogruppe B.
Ein weiterer MenB-Impfstoff, Trumenba® wurde zur aktiven Immunisierung für Personen ab dem vollendeten 10. Lebensjahr gegen invasive Meningokokken-Erkrankungen durch Neisseria meningitidis der Gruppe B Ende Mai 2017 zugelassen und ist seitdem in Deutschland verfügbar. Er enthält 2 rekombinant hergestellte Lipoproteine (Bivalent rLP2086): Faktor H-bindende Proteine (fHbp) der N. meningitidis Unterfamilie A und B, an Aluminiumphosphat adsorbiert.
Ausführliche Empfehlungen zu den Dosierungen von Bexsero® und Trumenba® wurden in der aktualisierten Stellungnahme der Kommission für Infektionskrankheiten und Impffragen der Deutschen Akademie für Kinder- und Jugendmedizin (24. Januar 2019) zusammen gefasst [6].
Zur Impfung gegen die Meningokokken Serotypen A, C, W, Y stehen aktuell 3 quadrivalente Impfstoffe zur Verfügung.
Menveo® wurde 2010 für eine aktive Immunisierung ab dem vollendeten 2. Lebensjahr zugelassen. Der Impfstoff enthält Oligosaccaride der Serotypen A, C, W-135, Y, die jeweils an Corynebacterium diphteriae CRM197– Protein konjungiert sind (Fachinformation Menveo®, Januar 2022, https://www.fachinfo.de/suche/fi/013142).
Mit Nimenrix® steht seit der Zulassung im April 2012 ein zweiter Konjugatimpfstoff zur Verfügung, der schon für Säuglinge ab 6 Wochen zugelassen ist. Der Impfstoff enthält Polysaccaride der Serogruppen A, C, W-135, Y und ist an Tetanustoxoid- Trägerprotein konjugiert (Fachinformation Nimenrix®, Februar 2021, https://www.fachinfo.de/suche/fi/015284).
MenQuadfi® wurde ist als jüngster Konjugatimpfstoff zur Immunisierung für Personen ab 12 Monaten im September 2020 zugelassen. Der Impfstoff enthält Polysaccaride der Serotypen A, C, W, Y und ist wie Nimenrix® an Tetanustoxoid- Trägerprotein konjugiert (Fachinformation MenQuadfi®, Dezember 2021, https://www.fachinfo.de/suche/fi/023174).
Tabelle 2 gibt eine Übersicht über die empfohlenen Dosierungen und Impfschemata von Menveo®, Nimenrix® und MenQuadfi® in Abhängigkeit vom Lebensalter.
Tabelle 2: Übersicht über die Dosierung und zugelassene Meningokokken-Impfschemata (A, C, W, Y) von Menveo®, Stand Fachinformation Januar 2022; Nimenrix®, Stand Fachinformation Februar 2021; und MenQuadfi®, Stand Fachinformation Stand Dezember 2021*
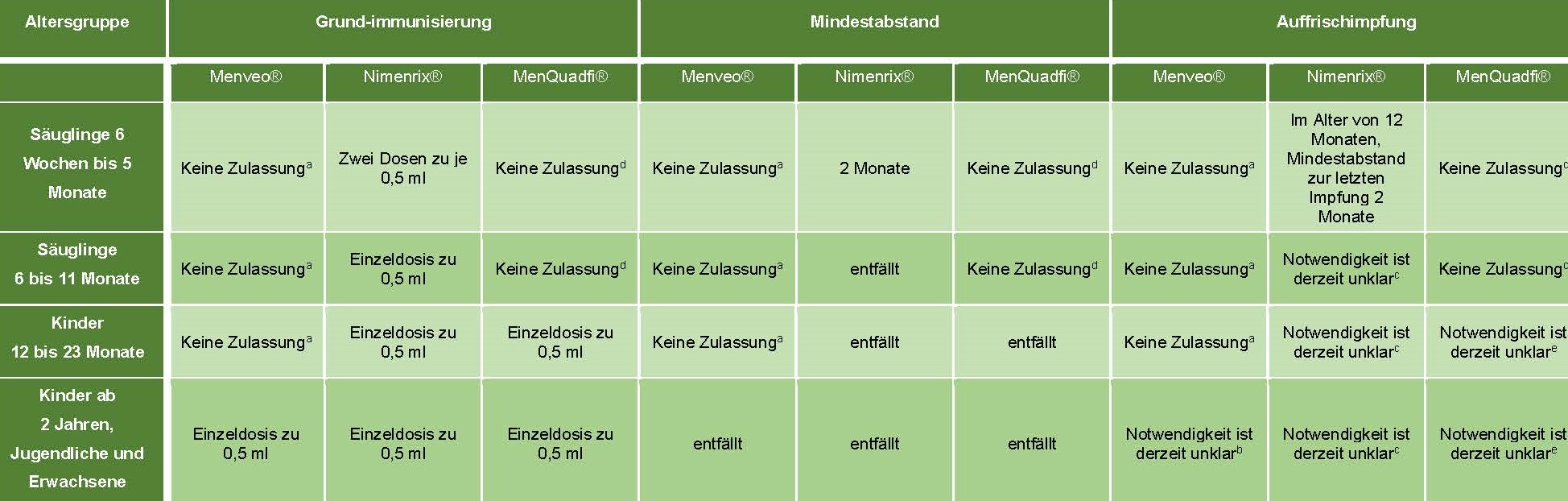 * Bzgl. der Dosierungen und Impfschemata von Bexsero® und Trumenba® bitte Referenz [6]
* Bzgl. der Dosierungen und Impfschemata von Bexsero® und Trumenba® bitte Referenz [6]
a Zulassung erst ab dem vollendeten 2. Lebensjahr
b Langzeitdaten zur Antikörperpersistenz sind nur für einen Zeitraum von bis zu 5 Jahren nach Impfung verfügbar.
c Personen, die zuvor eine Grundimmunisierung mit einem Konjugat- oder einfachen Polysaccarid-Meningokokken-Impfstoff erhalten haben, können ab einem Alter von 12 Monaten eine Auffrischimpfung mit Nimenrix® erhalten.
d Zulassung erst ab dem vollendeten 1. Lebensjahr
e Personen, die zuvor eine Meningokokken-Grundimmunisierung mit einem Meningokokken-Impfstoff mit denselben Serogruppen erhalten haben, können eine Auffrischimpfung in einer Dosis 0,5ml MenQuadfi® erhalten.
Zusammenfassung
Nach durchgemachter Meningokokken-Infektion besteht ein deutlich erhöhtes Risiko sich erneut mit einem anderen oder dem gleichen Serotyp zu infizieren und schwer zu erkranken. Das Risiko einer solchen rekurrierenden Meningokokken-Infektion ist bei Patienten mit bestimmen Grunderkrankungen wie Komplementdefekten (50% der rekurrierenden Meningokokken-Infektionen) besonders erhöht
Stellungnahme der Kommission
Die dargelegten Daten zeigen, dass das Risiko für eine rekurrierende invasive Infektion mit Meningokokken nach erster Infektionsepisode erhöht ist.
Die Kommission hält daher folgendes Vorgehen für sinnvoll:
- Kinder und Jugendliche ohne vollständigen Meningokokkenimpfstatus sollten unmittelbar nach Ausheilung einer invasiven Meningokokken-Erkrankung eine Impfung mit 4CMenB (Bexero®, Trumenba®) und/oder eine Impfung gegen die Serogruppen A, C, W und Y (Menveo®, Nimenrix®, MenQuadfi®) nach Vorgabe der Fachinformationen (siehe auch Tabelle 1) erhalten.
- Ein vorheriges isoliertes Screening auf Komplementdefekte ist für die Impfentscheidung bei diesen Patienten nicht erforderlich.
Deutsche Akademie für Kinder- und Jugendmedizin e.V.:
Mitglieder: Dr. med. Ulrich von Both (München), Dr. med. H. Grundhewer (Berlin), Prof. Dr. med. U. Heininger (Basel, Kommissionssprecher), Dr. med. A. Iseke (Münster), Prof. Dr. med. M. Knuf (Wiesbaden), Prof. Dr. med. G. Ch. Korenke (Oldenburg), Prof. Dr. med. A. Müller (Bonn, federführend)
Korrespondenzadresse:
Deutsche Akademie für Kinder- und Jugendmedizin e.V.
Prof. Dr. med. Prof. Dr. med. H.-I. Huppertz, Generalsekretär
Chausseestr. 128/129, 10115 Berlin, Tel.: 030.4000588-0, Fax.: 030.4000588-88
e-Mail: kontakt@dakj.de, Internet: www.dakj.de
Literatur
- Robert Koch Institut. Invasive Meningokokken-Erkrankungen 2012-2015. Epidemiol Bull. 2016(43).
- Koch-Institut R. Infektionsepidemiologisches Jahrbuch meldepflichtiger Krankheiten für 2019. Berlin 2020.
- Krone M, Lam TT, Claus H, Vogel U. Recurrent invasive meningococcal infections – quantifying the risk, Germany, 2002 to 2018. Euro Surveill. 2020;25(25). doi: 10.2807/1560-7917.ES.2020.25.25.1900565.
- Figueroa JE, Densen P. Infectious diseases associated with complement deficiencies. Clin Microbiol Rev. 1991;4(3):359-95. doi: 10.1128/CMR.4.3.359.
- Singwe-Ngandeu M, Buchs N, Rohner P, Gabay C. Waldenstrom’s disease complicated by recurrent meningococcal arthritis. J Clin Microbiol. 2001;39(8):3013-4. doi: 10.1128/JCM.39.8.3013-3014.2001.
- Huppertz HI, von Both U, Heininger U, Iseke A, Knuf M, Korenke GC, et al. Impfprophylaxe invasiver Erkrankungen mit Meningokokken der Serogruppe B. Monatsschrift Kinderheilkunde. 2019;167(8):711-20. doi: 10.1007/s00112-019-0698-0.


